科研进展
我所崔胜/高小攀团队合作揭示RNA抑制CRISPR抗病毒免疫分子机制
2025年12月30日,中国医学科学院病原生物学研究所崔胜团队、高小攀团队联合中国科学院物理所朱洪涛团队、北京胸科医院于霞研究员等在Molecular Cell期刊上在线发表题为“RNA anti-CRISPRs deplete Cas proteins to inhibit the CRISPR-Cas system”的研究论文。该工作通过结构生物学、生物化学等多学科手段阐明了Racrs与Cas蛋白形成异常复合物,抑制CRISPR-Cas抗病毒免疫系统分子机制。研究成果为基于Racrs的基因编辑调控奠定理论基础。
原核生物与移动遗传元件(MGEs)如噬菌体、质粒和转座子之间存在着持续不断的进化军备竞赛。这种竞争不仅驱动了多样化和复杂的抗病毒防御系统的进化,而且导致病毒也相应地发展出多种反防御策略。 CRISPR-Cas 系统在原核生物的宿主防御中尤为常见,作为一种适应性免疫系统,它能够将外源 DNA 整合到 CRISPR 基因座中,存储之前病毒入侵的信息。当遇到新的病毒入侵时, CRISPR-Cas 系统能够利用这些信息,特异性地抑制噬菌体和其他MGEs。目前,CRISPR-Cas系统已被广泛应用于基因编辑、基因检测、基因治疗和合成生物学研究中。
为了阻止或规避原核生物的宿主防御机制,噬菌体和 MGEs 进化出多种抗 CRISPR( Acr)蛋白质抑制剂。 Acr 蛋白通过干扰 CRISPR-Cas 免疫反应的不同阶段来抑制其活性。除了蛋白质,噬菌体还编码 CRISPR 类似序列,这些序列生成模拟的 crRNA,并作为基于 RNA 的 Acrs( Racrs)发挥作用。然而Racrs如何干扰CRISPR-Cas 系统的分子机制未知。
本研究分别解析了Type I-F 型 crRNA 引导监视复合物(Csy 复合物)以及由 RacrIF1 诱导形成的三种异常亚复合物的冷冻电镜(cryo-EM)结构。RacrIF1 在与经典 CRISPR 复合物 5′ 端手柄相应的位置缺乏特异性的 S 构象,而是呈现周期性的“5 + 1”排列模式。该构象会对 Cas5f-Cas8f 异源二聚体造成严重的空间位阻,从而削弱其结合能力。Racrs并不通过解离或破坏已形成的监视复合体,而是通过与crRNA竞争Cas6f和Cas7f,将这些关键蛋白导入非功能性的异常装配状态。从而失衡功能性 CRISPR-Cas 效应复合物的形成,最终抑制抗病毒免疫。该研究展示了RNA元件在调控抗病毒免疫系统中的直接作用方式,也为开发面向新一代CRISPR调控工具、噬菌体疗法与微生态干预策略提供了坚实的理论基础和结构依据。
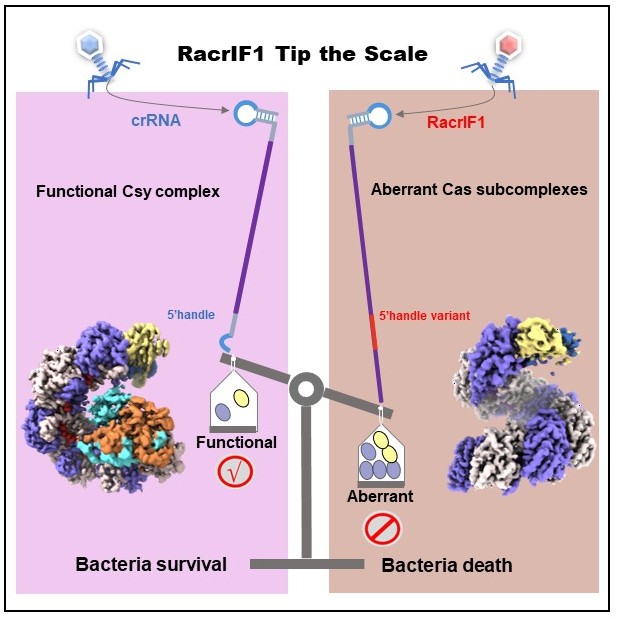
图.RacrIF1作用机制
我所崔胜研究员、高小攀研究员,中国科学院物理研究所朱洪涛特聘研究员,北京胸科医院于霞研究员为本文的共同通讯作者。我所高小攀研究员、朱凯祥助理研究员,北京胸科医院硕士研究生张伟贺,中科院物理所已出站博士后王琳为本文的共同第一作者。
