科研进展
我所江峰团队与以色列希伯来大学Asaf Levy团队合作在eCIS新型尾纤蛋白预测及验证研究方面取得新进展
2026年1月22日,我所江峰研究员团队与以色列希伯来大学Asaf Levy团队联合在Nature Communications杂志在线发表了题为“A comprehensive catalogue of receptor-binding domains in extracellular contractile injection systems”的研究论文。
细菌胞外收缩注射系统(eCIS)是原核生物中源自噬菌体尾部的毒素递送复合体,它们通过尾部纤维蛋白与靶细胞结合,在微生物与宿主的相互作用中发挥作用。与eCIS相关的基因座已通过生信计算的方法被广泛研究,包括各类eCIS的分类和生态分布分析。然而,在多数eCIS操纵子中对于尾部纤维基因的鉴定研究仍存在缺失。研究团队根据尾纤蛋白的保守结构域对细菌和古菌基因组中的eCIS尾纤蛋白基因进行了全面识别筛选,从1069种微生物的2585个eCIS基因座中鉴定出3445种尾纤蛋白编码基因并利用尾纤蛋白与eCIS基板连接的N端结构域差异将这些蛋白分为五大类。通过对其进行聚类分析,发现尾纤蛋白具有显著的结构多样性,存在276种独特的纤维类型和1,177种结构域折叠模式,其中有许多与真核生物的免疫或粘附蛋白相似,可能介导其与真核生物或细菌靶细胞表面的糖链及蛋白质结合。团队利用基因工程改造了带有多粘类芽孢杆菌属候选尾纤蛋白的eCIS并使用多种真核细胞检测其靶向性,发现该尾纤蛋白可以特异性靶向人单核细胞THP-1而非其它上皮细胞,随后注入毒性效应蛋白实现高效杀伤。基于尾纤蛋白结构的凝集素样结构域,本研究推测其可能通过与细胞表面糖类结合识别细胞,验证结果发现D-甘露糖可能干扰尾纤蛋白与THP-1细胞的结合。进一步通过Alphafold预测其结构与可能存在的糖基结合基序,发现突变其潜在结合基序后会使其杀伤靶细胞的能力下降,提示该基序可能介导尾纤蛋白的糖链识别和与膜的相互作用。这项研究揭示了eCIS靶标特异性决定因子的多样性并发掘了数千种与不同细胞类型结合的潜在尾纤蛋白,同时利用合成生物学手段验证了细胞表面多糖作为新型eCIS装置受体的可能,为后续将其设计为具有更多用途的精准递送载体提供了新的潜在靶点。
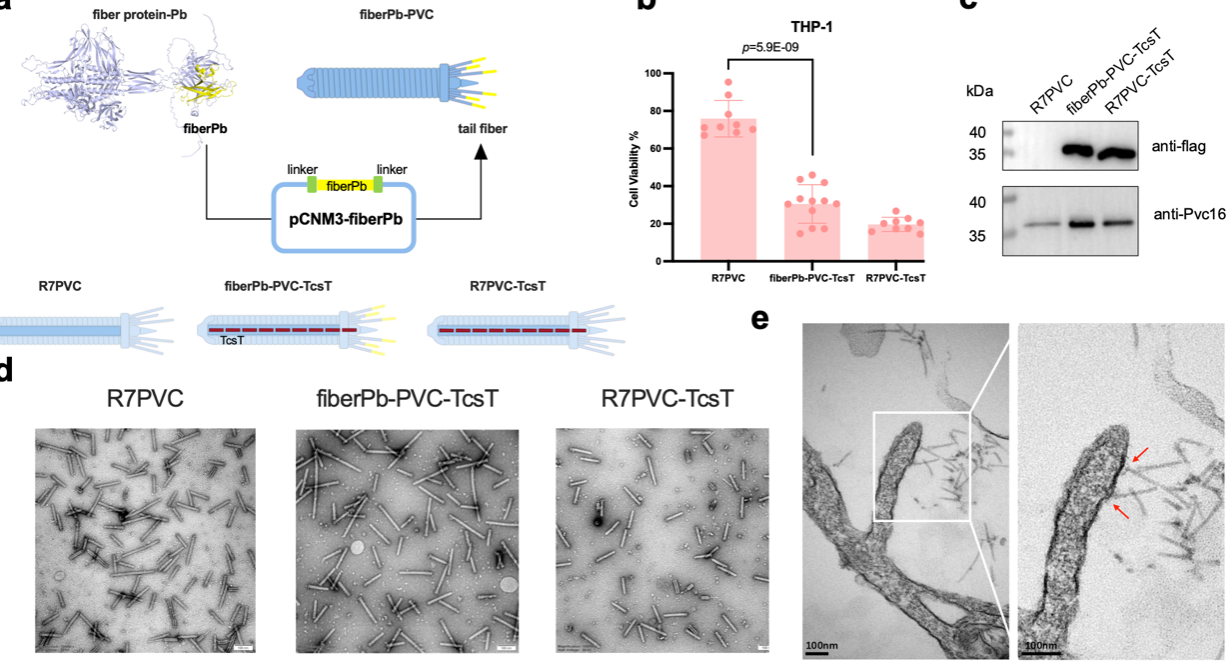
图. eCIS尾纤蛋白的改造与靶细胞识别
我所江峰研究员与以色列希伯来大学Asaf Levy教授为该论文的共同通讯作者,希伯来大学Nimrod Nachmias与我所博士生王知任为该论文的共同第一作者。
