科研进展
我所郭斐团队、首都医科大学同仁医院房居高团队合作在E3泛素连接酶MARCH8的功能研究方面取得进展
2025年11月4日,我所郭斐团队联合首都医科大学同仁医院房居高团队在《Journal of Biological Chemistry》杂志在线发表了题为“MARCH8-mediated ubiquitination regulates expression of the antiviral protein IFITM3”的研究论文。
MARCH(Membrane-associated RING-CH)家族是一类具有E3泛素连接酶活性的跨膜蛋白家族,它通过调控膜蛋白稳定性及泛素化修饰参与免疫调节和抗病毒防御。作为该家族重要成员,MARCH8通过调控主要组织相容性复合体II(MHC-II)、共刺激分子CD86、程序性死亡配体1(PD-L1)等免疫相关分子,及水泡性口炎病毒(VSV),人类免疫缺陷病毒(HIV)等病毒的包膜蛋白参与宿主的免疫调控和病毒的感染过程。目前对MARCH蛋白家族在宿主蛋白调控、病毒-宿主互作网络及疾病进程中的分子机制了解仍然有限。对MARCH8功能和作用机制的深入研究将有助于深化对宿主-病原体博弈规律的理解,也为靶向抗感染及宿主免疫的精准治疗策略提供理论支撑。
本研究通过免疫共沉淀(Co-IP)和液相色谱-质谱(LC-MS/MS)联用技术,鉴定出MARCH8的一个潜在底物:广谱抗病毒效应蛋白干扰素诱导的跨膜蛋白3(Interferon-induced transmembrane protein 3, IFITM3)。进一步研究发现MARCH8作为E3泛素连接酶,通过对IFITM3的赖氨酸24(K24)位点进行K63连接的多聚泛素化修饰,促进IFITM3的溶酶体降解,并精确调控IFITM3从质膜到内体和溶酶体的周转过程。利用干扰素(IFN)处理模拟生理条件IFITM3诱导表达的情况,敲除MARCH8可显著延缓IFITM3的降解,且在MARCH8敲除细胞中IFITM3显著滞留于质膜,提示MARCH8动态调控IFITM3的亚细胞定位进而影响其抗病毒功能。功能实验证实,敲除MARCH8抑制水泡性口炎病毒(VSV)及甲型流感病毒(IAV)假病毒的入侵,利用siRNA敲低IFITM3可逆转此抗病毒效应,表明MARCH8对细胞抗病毒能力的影响主要是通过对IFITM3蛋白表达的调控来实现。本研究对MARCH8通过调节天然免疫效应蛋白IFITM3的转运和表达来调控宿主抗病毒功能的研究,为宿主抗病毒防御机制提供了新内容。
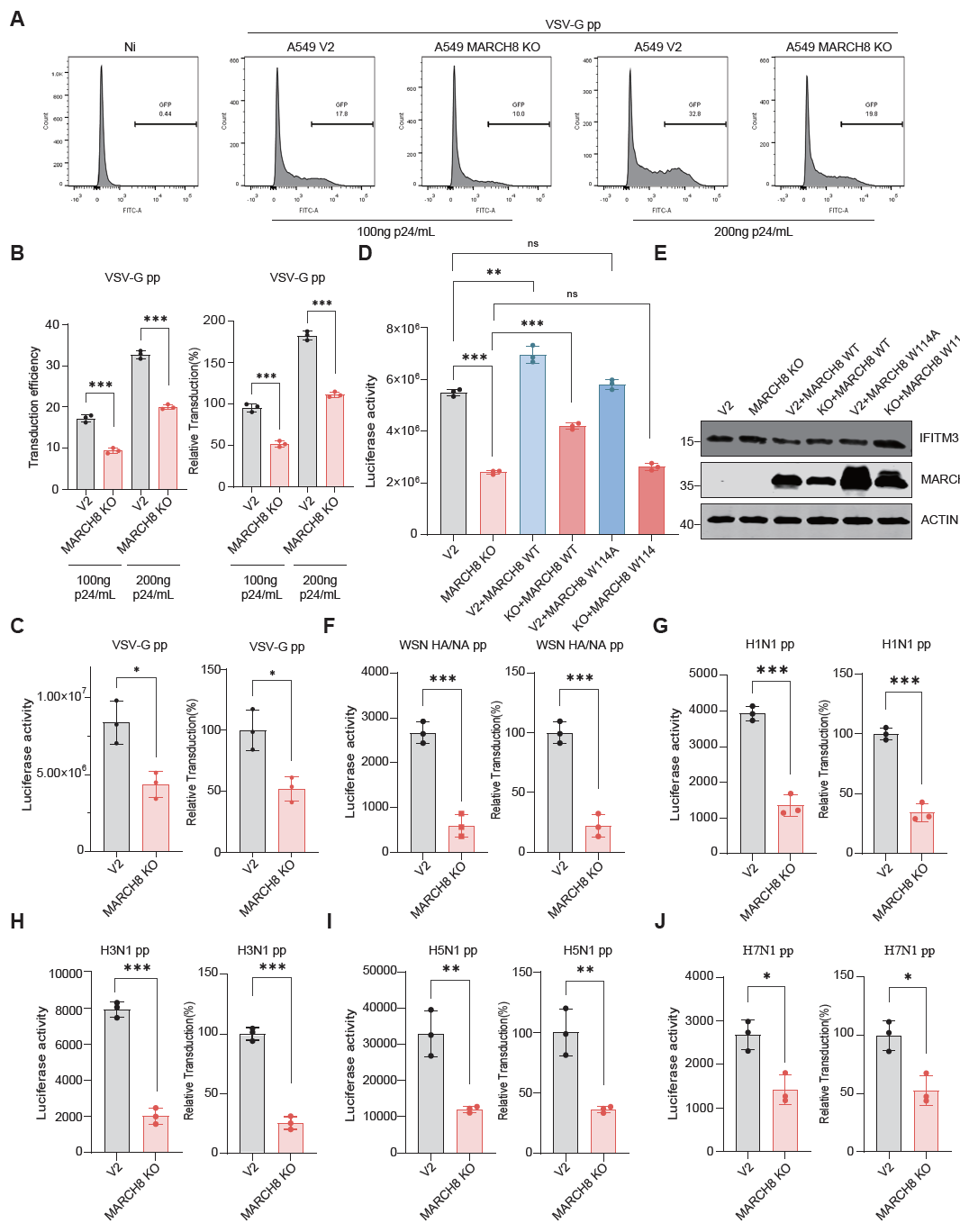
图. MARCH8调控IFITM3的抗病毒功能及细胞对病毒的易感性
我所郭斐研究员、首都医科大学同仁医院房居高教授、我所许丰雯副研究员为共同通讯作者。我所博士生魏亮、赵斐助理研究员、博士后刘晓满为论文共同第一作者。
