科研进展
崔胜、高小攀团队在冠状病毒与宿主互作机制领域取得新进展
2024年5月22日我所崔胜、高小攀研究团队和天津医科大学宓文义团队在Acta Pharmaceutica Sinica B杂志在线发表了题为“SARS-CoV-2 ORF10 hijacking ubiquitination machinery reveals potential unique drug targeting sites”的论文。
病毒常常操纵泛素化途径来促进其复制和致病性。由SARS-CoV-2感染引起的新冠肺炎症状包括咳嗽、发热、肌肉疼痛、疲劳、味觉和嗅觉能力下降。先前的研究表明,SARS-CoV-2辅助蛋白ORF10通过与cullin-2(CUL2) RING E3连接酶底物受体CUL2ZYG11B相互作用,增加其E3连接酶活性,促进纤毛蛋白IFT46的降解,导致纤毛功能异常。然而,ORF10被CUL2ZYG11B识别的分子机制尚不清楚。
本研究首先通过X射线晶体衍射技术解析了CUL2ZYG11B与SARS-CoV-2 ORF10 N端延伸部分(NTE)的复合物结构(2.9 Å),结构显示ORF10 N端七肽(NTH)模拟Gly/N-降解子肽构象,结合到CUL2ZYG11B。基于结构的突变实验验证了ORF10的关键氨基酸残基对其与CUL2ZYG11B在体外和细胞内的相互作用至关重要。随后,本研究证明了ORF10介导的增强CUL2ZYG11B对IFT46降解活性与ORF10-CUL2ZYG11B之间的结合亲和力相关。此外,通过Global Protein Stability system(GPS),本研究证明了ORF10模拟Gly/N-降解子,与CUL2ZYG11B竞争性结合并抑制携带Gly/N-降解子的目标底物的降解。
综上所述,ORF10与CUL2ZYG11B之间的相互作用通过两种不同的机制促进IFT46的降解并抑制携带Gly/N-降解子的CUL2ZYG11B靶标底物的降解:(1)通过非经典机制途径,ORF10增加了CUL2ZYG11B活性,导致IFT46的降解;(2)通过经典机制途径,ORF10的N端延伸(NTE)作为Gly/N-降解子的模拟物与CUL2ZYG11B结合,并竞争性抑制CUL2ZYG11B与其携带Gly/N-降解子的目标底物的结合。
这项研究揭示了SARS-CoV-2的ORF10如何利用泛素化机制进行蛋白酶体降解,并为基于ORF10 NTH肽与CUL2ZYG11B相互作用的PROTAC药物设计优化提供了宝贵见解,同时为COVID-19的药物研发提供了潜在药物靶标。
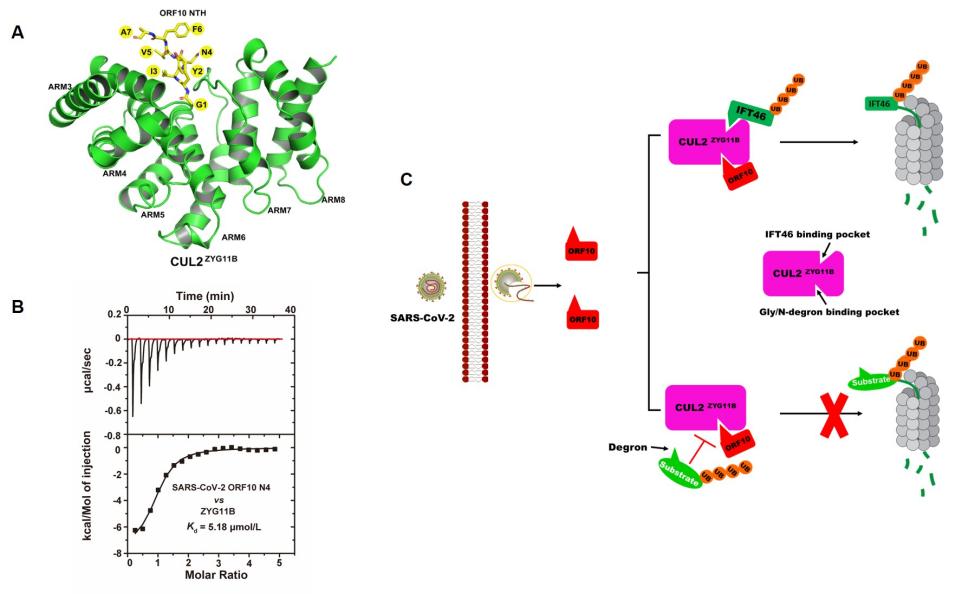
图.SARS-CoV-2 ORF10与CUL2ZYG11B相互作用劫持泛素化的分子机制
本研究工作得到中国医学科学院医学与健康科技创新工程(2022-I2M-1-021)、国家自然科学基金(82341095,82272308)等项目的资助。中国医学科学院病原生物学研究所崔胜研究员,高小攀研究员和天津医科大学基础医学院宓文义教授为论文共同通讯作者。协和青年学者朱凯祥博士,天津医科大学基础医学院博士生宋丽丽,中国医学科学院病原生物学研究所硕士生王临岳,中国医学科学院病原生物学研究所与延安大学联培硕士生花蕾为论文共同第一作者。
