科研进展
我所崔胜团队、何玉先团队合作在免疫因子Shiftless抗病毒分子机制研究中取得新进展
2025年12月19日,我所崔胜团队、何玉先团队联合在《Science Advances》杂志在线发表题为“Phosphorylation of Shiftless is Important for Inhibiting the Programmed -1 Ribosomal Frameshift”的研究论文。
病毒感染人体后,会刺激机体的免疫反应产生干扰素,并产生一系列干扰素刺激因子。研究团队聚焦于宿主与病毒互作机制研究,先后解析了典型干扰素刺激因子Schlafen(SLFN)家族成员SLFN11和SLFN14的结构,并揭示了二者利用宿主-病毒密码子偏好性不同抑制HIV-1复制等机制。
Shiftless(SFL)作为另一种干扰素刺激因子,能够通过不同途径抑制多种病毒的复制,包括丙型肝炎病毒(HCV)、登革热病毒(DENV)、西尼罗病毒(WNV)、寨卡病毒(ZIKV)、基孔肯雅病毒(CHIKV)和新冠病毒(SARS-CoV-2)等。近年来有研究表明SFL能够通过调节程序性-1核糖体移码(-1 PRF)过程有效地抑制HIV-1复制,但其抗病毒分子机制尚未完全阐明。研究团队首次解析了人SFL全长蛋白高分辨率(2.0 Å)结构,发现其具有三个锌指结构域以及一个“超磷酸化环”。四个磷酸化的氨基酸残基(p-Ser249、p-Thr250、p-Thr253和p-Ser256)位于“超磷酸化环”上,它们对SFL与HIV-1 RNA亲和力产生不同程度的影响。深入研究发现,p-Thr250和p-Thr253在SFL介导的-1 PRF途径抑制病毒复制过程中发挥了关键作用。利用邻近生物素化标记技术,研究团队进一步鉴定到了三个负责SFL磷酸化的Ser/Thr激酶(EEF2K、NEK9和PBK)。本研究揭示了SFL调控-1 PRF的机制,并为SFL在免疫中的作用提供了见解,有望提供新的广谱抗病毒策略。
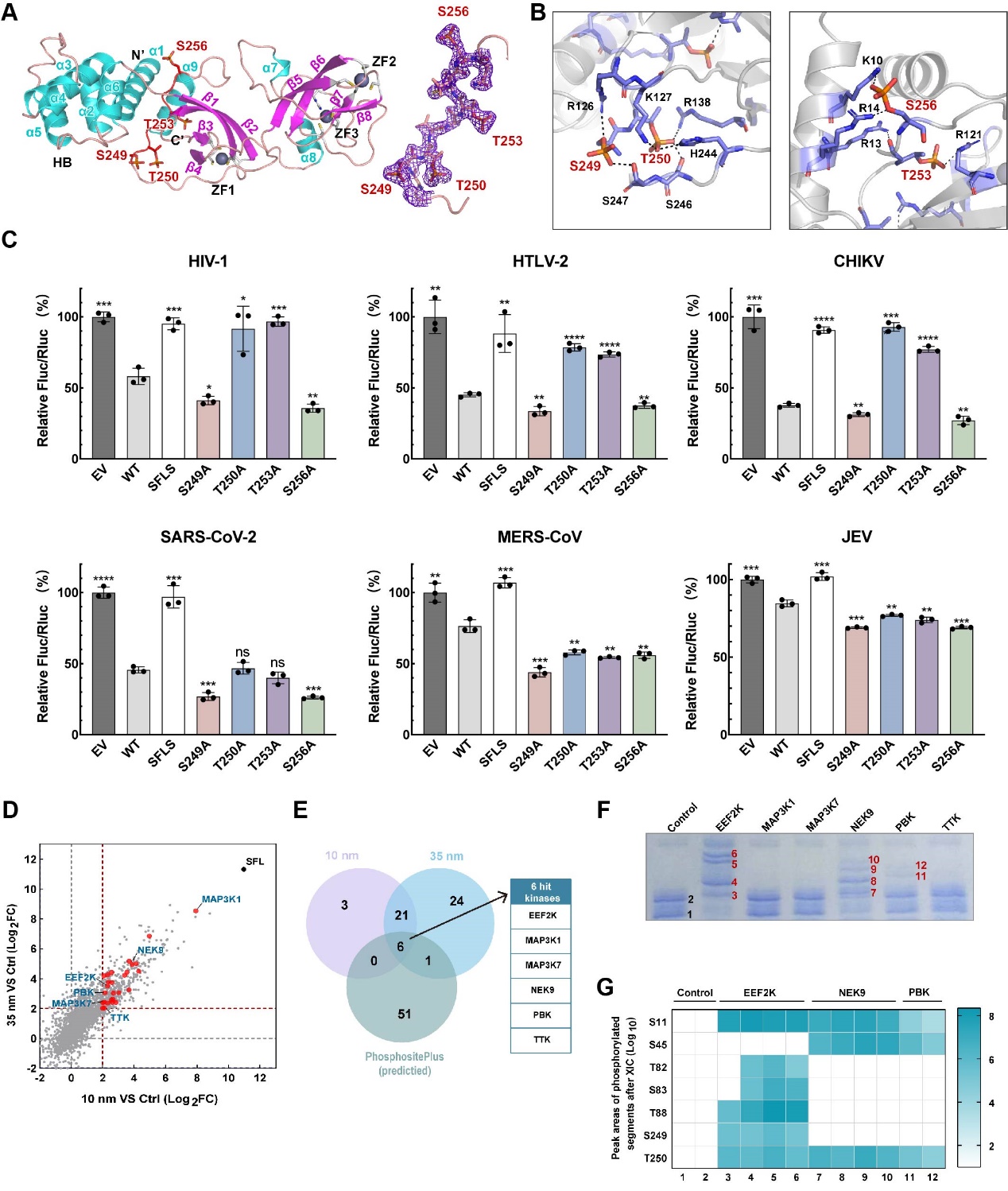
图. SFL磷酸化位点的结构、功能及上游激酶鉴定
何玉先团队和崔胜团队共同隶属于中国医学科学院艾滋病研究中心,在抗HIV膜融合抑制剂研发和HIV的感染及致病机制研究方面具有长期且深入的合作基础。我所博士研究生张月丽、李智剑助理研究员为本论文的共同第一作者。我所崔胜研究员、何玉先研究员、李智剑助理研究员为本论文的共同通讯作者。
